Advanced Science | 郑宏庭教授团队揭示GCGR激活下的肝脏脂肪代谢调控新机制

英文标题:CD9 Counteracts Liver Steatosis and Mediates GCGR Agonist Hepatic Effects
发表期刊:Advanced Science
影响因子:14.3
客户单位:中国人民解放军陆军军医大学第二附属医院
百趣提供服务:靶标代谢流
代谢功能障碍相关脂肪性肝病(Metabolic Dysfunction Associated Steatotic Liver Disease, MASLD)的特征是肝细胞内脂质过度积聚,已成为慢性肝病和肝细胞癌的主要原因。胰高血糖素受体(Glucagon receptor, GCGR)激动剂是治疗肝脏脂肪变性的一种有前途的治疗选择,而GCGR激活在治疗MASLD中的潜在机制仍不清楚。本文发现四跨膜蛋白CD9可能介导GCGR激动剂的肝脏作用。CD9在MASLD患者的脂肪肝中表达减少,并在GCGR激活时上调。肝脏中CD9的缺乏通过调控补体因子D(Complement Factor D, CFD)介导的脂肪酸代谢,加剧饮食诱导的肝脂肪变性。因此,CD9可以调节GCGR信号对肝脏的有益作用,并可能成为治疗肝脏脂肪变性的有希望的靶点。
1.CD9在患者和小鼠的脂肪肝中下调,并在GCGR激活后上调
为了筛选可能与GCGR激动剂对肝脏的影响相关的基因,作者分析了两个公开的基因表达数据集。一个是注射了高选择性GCGR激动剂的小鼠肝脏(GSE135881),据报道该激动剂可改善肝脏脂肪变性。另一个是高脂肪饮食(High-Fat Diet, HFD)诱导的脂肪肝(GSE94754),12个基因在GCGR激动剂治疗和疾病模型之间表现出相反的表达变化,在GLP-1/GCGR激动剂(Cot)激活GCGR信号后,肝脏中的CD9和NOX4表达发生了变化,并且CD9的改变比NOX4更明显。随后研究了CD9参与GCGR信号对肝脏的影响的可能性。在MASLD患者的肝脏中观察到mRNA和蛋白质水平的CD9显著降低(图1B)。与相应的对照相比,小鼠模型(HFD、ob/ob和db/db)的肝脏中CD9表达持续下调(图1C)。此外,在体内和体外,Cot激活GCGR信号后,肝脏中CD9表达均上调。
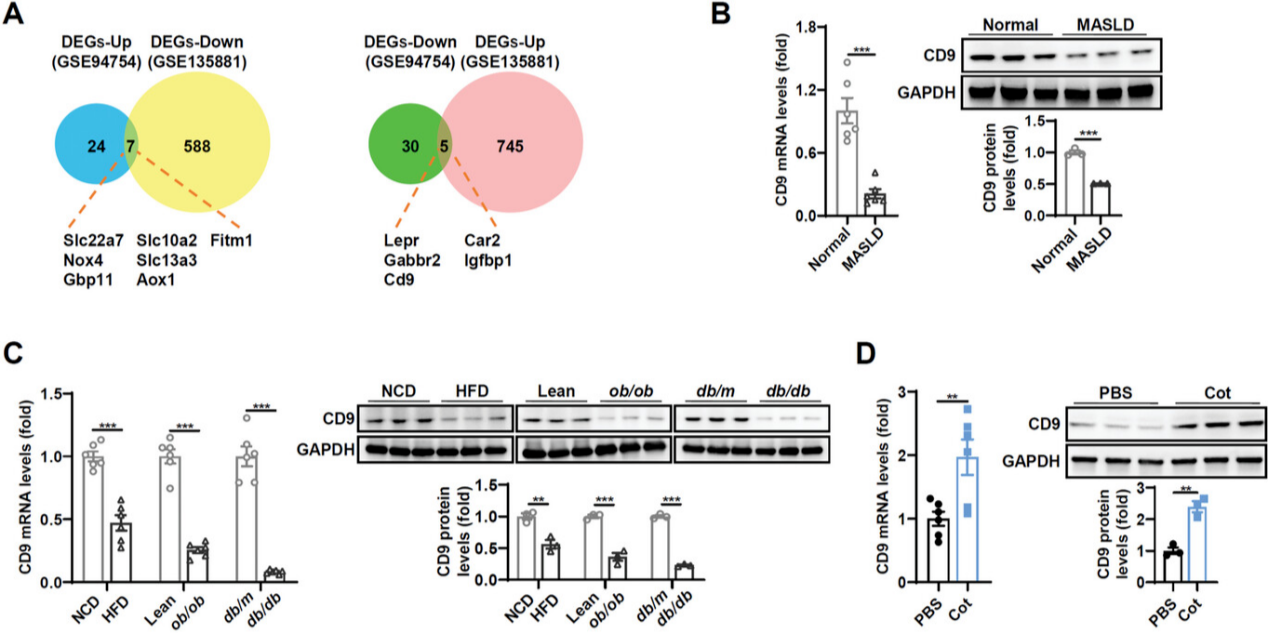
图1 肝脏CD9在患者和小鼠的脂肪肝中下调,在GCGR激活后上调
2.肝脏中CD9缺失通过调节脂肪酸代谢加剧HFD下的肝脏脂肪变性
作者用含有肝细胞标志物甲状腺素结合球蛋白(TBG)启动子的重组腺相关病毒8载体(AAV8)敲低肝脏CD9(即AAV-shCD9)。AAV-shCD9治疗导致小鼠肝脏中CD9特异性缺失,但不会在骨骼肌、脂肪组织、大脑或肾脏中缺失。观察到AAV-shCD9小鼠和正常饮食(normal chow diet,NCD)下的AAV-shCtr小鼠的肝脏脂肪变性之间没有显著差异,与HFD处理下的AAV-shCtr小鼠相比,AAV-shCD9小鼠的肝脏脂肪变性更为严重,体重、肝重和肝重/体重增加。还检测到高表达的肝脏甘油三酯(TG),组织学和油红O染色进一步证实了AAV-shCD9小鼠肝细胞中脂质积累明显加剧(图2C)。
此外,RNA测序(RNA-seq)和进一步的qPCR分析均表明,CD9缺乏主要增加脂肪酸合成基因,而不是与脂肪酸吸收和运输相关的基因。脂肪酸合成基因增加和脂肪酸氧化基因减少进一步通过其在敲低CD9小鼠肝脏中的蛋白质表达得到验证。根据体内实验结果,转染CD9小干扰RNA(siRNA)后,肝细胞内TG含量和脂质积累增加,而在游离脂肪酸处理下CD9过表达则减弱(图2E、F)。此外,13C同位素测定评估体外脂肪生成和脂肪酸氧化进一步证实了CD9对脂肪生成和脂肪分解的调节(图2G)。总之,这些发现表明CD9缺乏通过增强脂肪酸合成和抑制HFD下的氧化来加速肝脏脂肪变性。

图2 肝脏CD9缺乏会加剧HFD诱发的肝脏脂肪变性
3.CD9通过FLI1泛素化调控CFD通路来调节肝脏脂肪酸代谢
研究通过分析CD9基因缺失时肝脏中差异表达的基因,探讨了CD9对肝脏的影响。排名第一的基因CFD的mRNA表达发生了显著变化。进一步分析发现,CD9和CFD在MASLD进展过程中呈负相关。CFD的敲除抑制了CD9缺失诱导的肝脏脂肪变性,而CFD的过表达导致了与CD9缺失相似的效果。这些发现表明,CD9缺失主要通过CFD诱导加速肝脏脂肪变性(图3)。

图3 低表达CD9通过诱导CFD表达促进肝脏脂肪变性
研究调查了CD9如何在分子水平上调节CFD。体内结果显示,CD9操作会影响CFDmRNA水平,这表明CD9在基因转录本水平调节CFD。FLI1等转录因子对CFD的调控非常重要。瞬时转染试验和染色质免疫沉淀试验证实了FLI1与CFD之间的相互作用。FLI1的调节是CD9对肝细胞产生影响的原因。进一步的实验表明,CD9通过翻译后机制调节FLI1蛋白的稳定性。FLI1与野生型HA-泛素或缺乏K48和K63链的泛素突变体共表达显示,CD9过表达会减少FLI1的泛素化,而K48R和K63R突变体则会消除泛素化。将突变体FLI1(K344R)与HA泛素共表达显示,CD9的过量表达抑制了FLI1的泛素化,而K344R突变体的抑制作用减弱。这表明FLI1蛋白的K344残基可能是CD9调控FLI1泛素化的关键位点。通过共沉淀实验还发现了CD9与FLI1的相互作用。作者将CD9与质膜标记物钠钾ATP酶共染色。结果显示,CD9的亚细胞定位在质膜上。CD9与FLI1的共染显示了它们的共定位。表明CD9-FLI1的相互作用是在质膜附近。综上所述,这些数据表明CD9通过FLI1的泛素化-蛋白酶体降解来调节CFD(图4)。

图4 CD9通过泛素化-蛋白酶体降解FLI1来调节CFD表达和肝脏脂肪酸合成与氧化基因
4.CD9通过CFD调节脂肪组织的脂肪生成和燃烧来影响体重
在肝脏中敲低CD9会导致体重变化,脂肪组织的重量增加,脂肪细胞体积增大。间接热量测定法研究显示,CD9影响能量消耗,但不影响食物摄入或体力活动。在CD9基因缺陷小鼠的脂肪组织中观察到产热基因减少和脂肪生成基因增加。CD9缺陷小鼠的血清诱导脂肪细胞中的脂肪生成基因,这可能是通过循环因子CFD实现的。CD9缺陷小鼠体内的CFD水平升高,其受体C5aR在调节脂肪细胞功能方面发挥了作用(图5)。
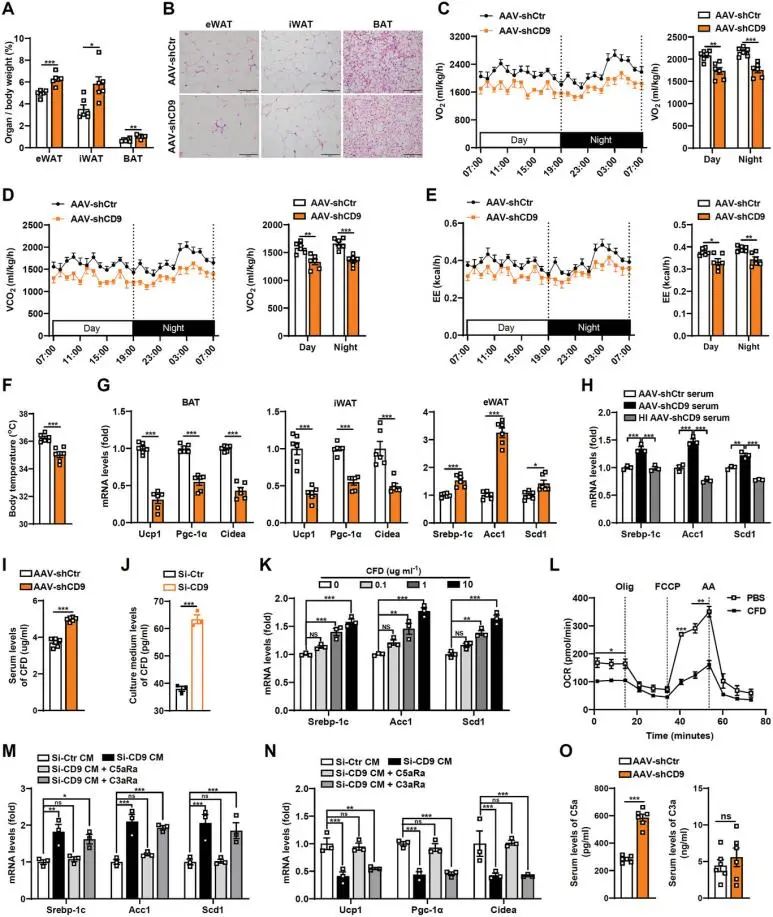
图5 CD9通过CFD控制脂肪组织的脂肪生成和代谢从而影响体重
5.过表达肝脏中的CD9可减轻肝脏脂肪变性
接下来,作者评估了在HFD小鼠中挽救肝脏CD9表达的效果(图6A)。AAV8-TBG-CD9过表达肝脏CD9显著降低了体重、肝重和肝重/体重(图6B),并改善了肝脏TG、脂质积累以及相关的脂质基因和蛋白质表达(图6C-E)。丙氨酸氨基转移酶的肝酶活性显著降低,表明AAV-CD9也改善了肝功能(图6F)。此外,CD9强化降低了CFD并增加了FLI1蛋白水平(图6G),这与前面提到的机制观察结果一致。这些发现表明CD9过表达可减轻MASLD的发展。

图6 肝脏中CD9的过度表达可改善HFD引起的肝脂肪变性
6.CD9促进GCGR激活对肝脏的益处
为了确定CD9是否参与了GCGR激动剂对肝脏的影响(图7A)。作者使用了GCGR/GLP1R双激动剂Cot,因为已经证明肝脏作用主要通过GCGR实现,而肝外改善则通过GLP1R实现。结果发现Cot缓解了肝脏脂肪变性,表现为体重、肝重和肝重/体重比、肝脏TG含量和形态的降低,以及脂肪酸合成和氧化基因和蛋白质的改变,用AAV-TBG-shCD9降低肝脏CD9可显著消除Cot治疗对脂肪变性和脂质蓄积的缓解,体重除外(图7B-E),这些结果表明Cot对肝脏有益是通过CD9引起的GCGR信号转导实现。而不是GLP1R引起的肝外体重改善。
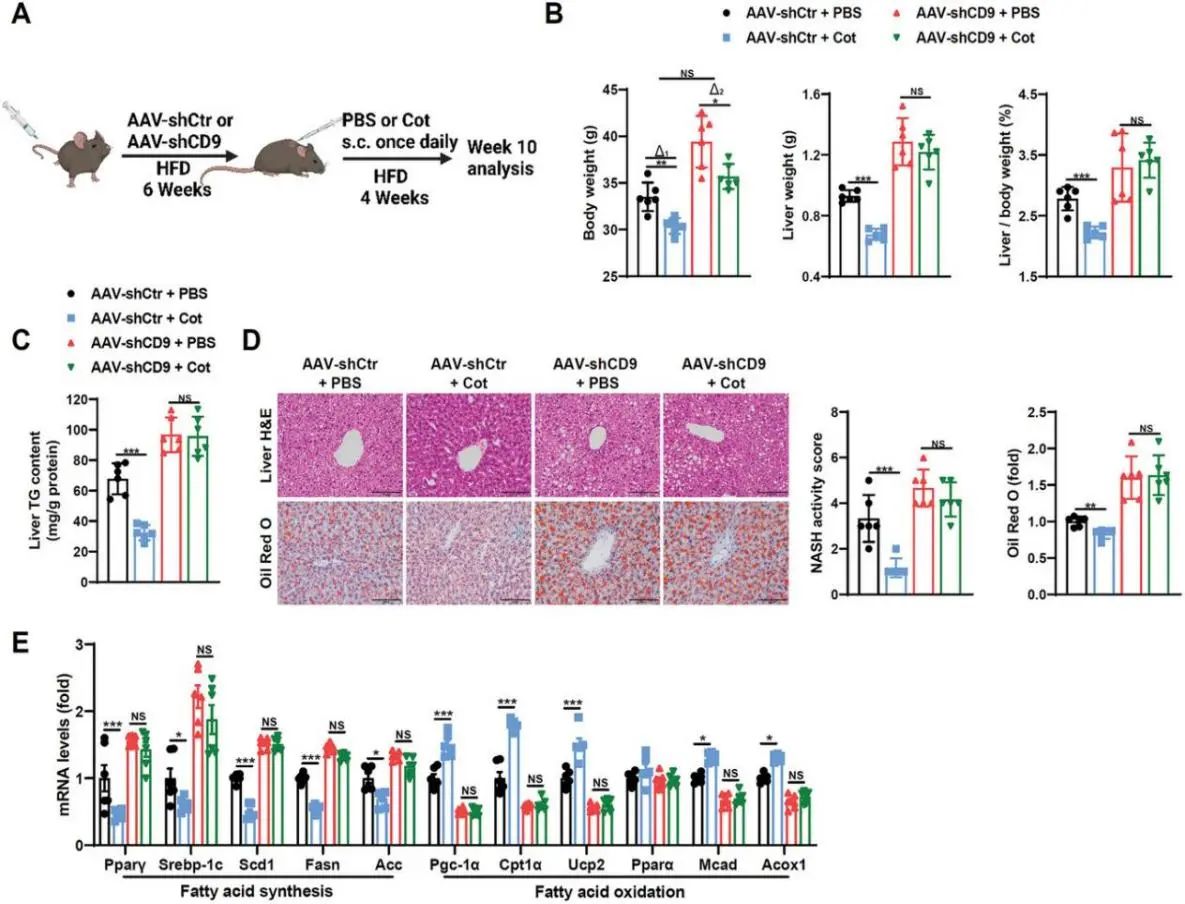
图7 CD9的缺失会消除cot对HFD小鼠肝脏的有益作用
本文筛选了四跨膜蛋白CD9可能调节GCGR激动剂的肝脏作用。CD9在MASLD患者的脂肪肝中减少,并在GCGR激活时上调。作者发现CD9通过泛素化-蛋白酶体降解FLI1来调节CFD表达,从而调节肝脏脂肪酸合成和氧化基因。CD9通过CFD调节脂肪组织的脂肪生成和产热,从而影响体重,减轻肝脂肪变性。因此,CD9可以调节GCGR信号对肝脏的有益作用,并可能成为治疗肝脏脂肪变性的有希望的靶点。
END
张慧 撰文
Peng 校稿
